Gonfler un ballon sans souffler ?
De Wikidebrouillard.
(→'''Matériel''') |
(→'''Matériel''') |
||
| Ligne 7 : | Ligne 7 : | ||
* [[Image:Bouteille en verre.jpg|50px]]1 petite [[bouteille]] en verre vide | * [[Image:Bouteille en verre.jpg|50px]]1 petite [[bouteille]] en verre vide | ||
* 1 entonnoir | * 1 entonnoir | ||
| - | * [[Image: | + | * [[Image:Ballonjaune.jpg|100px]] 1 [[ballon de baudruche]] |
* 1 cuillère à soupe | * 1 cuillère à soupe | ||
Version du 10 avril 2008 à 09:44
Pour les enfants de 8 à 12 ans!!
Sommaire |
Matériel
- du bicarbonate de sodium (alimentaire)
-
 du vinaigre
du vinaigre
-
 1 petite bouteille en verre vide
1 petite bouteille en verre vide
- 1 entonnoir
-
 1 ballon de baudruche
1 ballon de baudruche
- 1 cuillère à soupe
L'expérience
Pour un récipient type bouteille de verre :- Remplis la bouteille de vinaigre avec environ 2/3.
- Verse 2 cuillères à soupe de bicarbonate de sodium à l'intérieur du ballon de baudruche, à l'aide de l'entonnoir.
- Enfile le ballon, sur le goulot de la bouteille. Assure-toi que le ballon tient aux bord du goulot de la bouteille.
- Soulève le ballon pour faire tomber le bicarbonate dans la bouteille.
- Que se passe-t-il?
Explication
Résumons
Lorsque le bicarbonate tombe dans la bouteille, des bulles se forment dans le liquide et le ballon se met à gonfler. Ces bulles sont produites par la réaction chimique entre le vinaigre et le bicarbonate. Cela nous permet de dire qu'un des produits de la réaction chimique entre le vinaigre et le bicarbonate est un gaz puisqu'il gonfle le ballon. Grâce au ballon, on capture un gaz invisible produit par une réaction chimique!
Le vinaigre est un liquide, le bicarbonate est une poudre composée de minuscules grains solides. Lorsque ces deux produits réagissent ensemble (on les appelle des réactifs), ils donnent naissance à un nouveau produit qui lui est un gaz. Ce dernier n'est pas le seul produit issu de la réaction. En effet, lorsqu'on goûte le liquide, il ne pique plus la langue comme le vinaigre mais il a un goût salé! Le vinaigre et le bicarbonate se sont aussi transformés en une sorte de sel qui est dissous dans le liquide; le sel et le gaz sont les produits de la réaction.
Poussons un peu plus loin
Nous avons à faire à une réaction acido-basique. Ici le vinaigre, qui contient de l'acide éthanoïque, joue le rôle de l'acide et le bicarbonate de soude, aussi appelé hydrogenocarbonate de sodium, celui de la base.
En solution ce dernier ce dissoud en formant deux ions différents : les ions sodium et hydrogenocarbonate.
<math>NaHCO_{3}_{s} \rightarrow Na^{+} + HCO_{3} ^{-}</math>
Ce sont ces derniers qui vont réagir avec le vinaigre pour former de l'eau et du dioxyde de carbone selon la réaction suivante :
<math>CH_{3}COOH_{(l)} = CH_{3}COO^{-}_{(aq)} + H^{+}</math>
<math>HCO_{3}^{-}_{(aq)} + H^{+} = CO_{2}_{(g)} + H_{2}O_{(l)}</math>
______________________________________________________________________
<math>CH_{3}COOH_{(l)} + HCO_{3}^{-}_{(aq)} \rightarrow CH_{3}COO^{-}_{(aq)} + CO_{2}_{(g)} + H_{2}O_{(l)}</math>
On obtient alors une eau au goût salé en raison de la présence en début de réaction des ions sodium. En effet, lorsque l'on dissoud du sel (chlorure de sodium) dans de l'eau, on obtient bien ces ions sodium responsable du goût salé (et des ions chlorure).
Le dioxyde de carbone quant à lui ne peut pas se dissoudre dans l'eau. Il remonte donc à la surface du liquide sous forme de bulles, avec la poussée d'Archimède.
En effet, ce gaz est non polaire tout comme peut l'être l'huile. Alors que l'eau est une molécule polaire : sa configuration provoque l'apparition de "pôles" négatifs et positifs (voir schéma un peu plus bas).
On peut facilemment ce rendre compte que les molécules non polaires et polaire s'associent en général très difficilement (exemple : eau + huile = eau + huile). Pour expliquer cela, il faut observer ces molécules d'un peu plus près...
Pour commencer prenons l'eau (H2O) sous forme liquide :
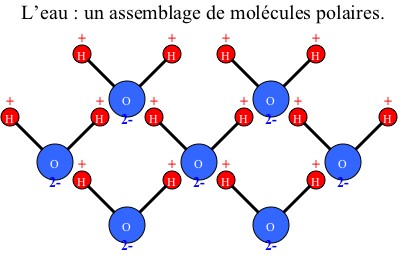 ______________________________________________________________________
______________________________________________________________________
Puis du sel (NaCl) :
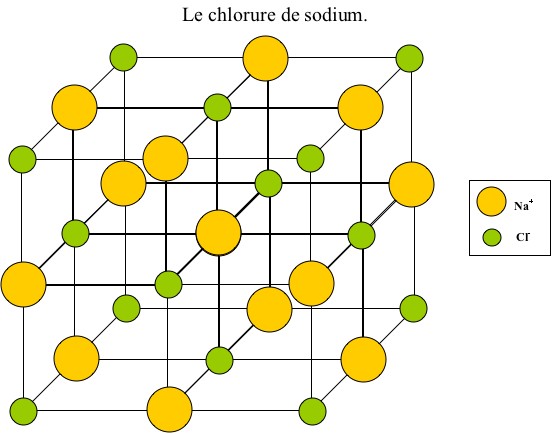 ______________________________________________________________________
______________________________________________________________________
Puis du dioxyde de carbone (C02) :
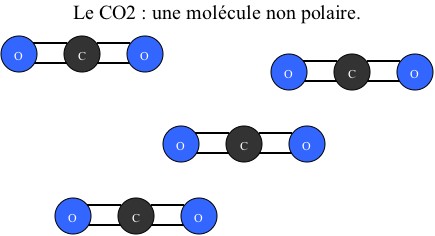
Remarque : la polarité de ces molécules est due à leur forme. Lorsque tous les atomes sont alignés, il n’existe pas de moment dipolaire entre eux. Tandis que lorsqu’ils sont configurés différemment, les différentes charges ne sont plus alignées et il y a création d’un moment dipolaire et donc de « pôles ».
Et faisons des "mélanges" :
Dans un premier temps, on mélange l'eau avec le sel. Les molécules d'eau s'associent aux molécules de sel par "pôles" préférentiels (+ avec - et - avec +). Elles entourent ces molécules pour former une sorte de barrière où seules les molécules d'eau peuvent s'attacher. La forme cristalline du sel disparaît alors pour former les ions Na+ et Cl-. On parle de l'hydratation du sel.
Dans un second temps, on mélange le CO2 avec un liquide acide. Les molécules d'eau ne peuvent s'associer aux molécules de dioxyde carbone car ces dernières ne possèdent pas de "pôles". Elles ne peuvent donc pas hydrater le dioxyde carbone et celui-ci reste sous forme de gaz.
Concepts scientifiques associés
ne pas hésiter à faire des liens avec l'encyclopédie :Wikipédia
Application : Lien avec le quotidien
Liens avec d'autres expériences
Comment fabriquer un extincteur ?
Utiliser les bonnes doses de vinaigre et de bicarbonate de sodium.
Comment éteindre une flamme sans eau?
Comment l'animer ?
Pour les enfants de 8 à 12 ans, faire attention aux doses du bicarbonates et du vinaigre. Tester avant toutes réalisation avec les enfants!
Liens avec des programmes d'animation
Comme par exemple "Debout les terriens", "foot'sciences", "6TdB", ...

