Electrolyse de l'eau
De Wikidebrouillard.
Sommaire[masquer] |
Présentation de l'expérience
L'eau, c'est de l'eau ! Ben non ! L'eau c'est composé d'autres éléments chimiques !! Comment décomposer l'eau ?
Matériel
-
 de l'eau
de l'eau
-
 1 récipient (bocal, bassine ou autre)
1 récipient (bocal, bassine ou autre)
-
 1 pile de 4,5 V (ou plus puissante)
1 pile de 4,5 V (ou plus puissante)
-
2 clous (ou autres tiges de métal)
-
2 tubes à essai
-
 2 cables électrique avec pinces crocodiles
2 cables électrique avec pinces crocodiles
-
 du sel (ou tout autre électrolyte)
du sel (ou tout autre électrolyte)
-
 1 briquet
1 briquet
L'expérience
La manipulation
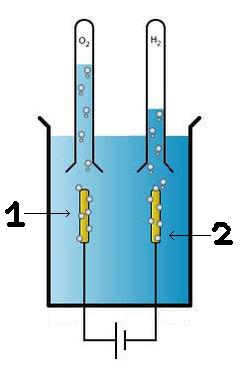
Remplir le récipient avec de l'eau et y ajouter l'électrolyte (ici, nous utilisons du sel). Prendre les deux clous ou les deux tiges de métal choisies et les placer dans chacun des tubes à essai, le but étant de récupérer l'hydrogène produit par l'électrolyse.
Brancher la pointe équipée du récupérateur (tube à essai) sur le pôle (-), la cathode, c'est là que l'hydrogène sera récupéré. Brancher l'autre pointe équipée du récupérateur (tube à essai) sur l'autre pôle (+), l'anode, c'est là que sera récupéré l'oxygène. Attendre et observer.
Légende :
- 1 : Anode
- 2 : Cathode
Que voit-on ?
Des petites bulles commencent à apparaître sur les tiges de métal : c'est de l'oxygène (O) au pôle (+) et de l'hydrogène (H) au pôle (-). Au bout d'une heure, s'il n'y a pas assez de gaz dans les tubes, on peut rajouter du sel pour booster la réaction. Une fois que l'on a récupéré assez d'hydrogène, on peut le faire exploser en approchant la flamme du briquet au moment où on le relâche. Un peu d'entraînement sera peut-être nécessaire au début.
Explications
De manière simple
Comment sait-on que l'hydrogène est présent ?
Le courant électrique dissocie la molécule d'eau (soit H2O) en ions hydroxyde (OH)- et hydrogène H+ : dans la cellule électrolytique, les ions hydrogène acceptent des électrons à la cathode dans une réaction d'oxydation en formant du dihydrogène gazeux (soit H2), alors qu'une oxydation des ions hydroxyde - qui perdent des électrons donc - se produit à l'anode ce qui produit l'oxygène (o2).
On constate aussi que le volume de l'hydrogène est deux fois celui de l'oxygène. On utilise une flamme pour constater la présence de l'hydrogène puisque c'est un gaz très inflammable.
L'électrolyte ?
L'eau pure conduit peu l'électricité, ce qui contraint à l'emploi d'un additif hydrosoluble - électrolyte - dans la cellule d'électrolyse pour « fermer » le circuit électrique (autrement dit, faire en sorte que les potentiels chimiques en jeu permettent la réaction chimique). L'électrolyte se dissout et se dissocie en cations et anions (c'est-à-dire respectivement des ions chargés positivement et négativement) qui peuvent « porter » le courant. Ces électrolytes sont habituellement des acides, des bases ou des sels.
Questions sans réponses
Allons plus loin dans l'explication
L'électrolyse de l'eau avec une explication plus mathématiques sur Wikipédia : Électrolyse de l'eau
Liens avec d'autres expériences
Expériences sur le Wikidébrouillard
Autres expériences
Applications : liens avec le quotidien
Production d'hydrogène comme carburant du futur, pour les bombes H, etc.,...