Gaz parfaits
De Wikidebrouillard.
(→'''Matériel''') |
m (→'''Concepts scientifiques associés''') |
||
| Ligne 35 : | Ligne 35 : | ||
== '''Concepts scientifiques associés''' == | == '''Concepts scientifiques associés''' == | ||
L'état d'équilibre thermodynamique d'un gaz parfait est fixé ( n moles de molécules) par deux paramètres macroscopiques au choix. Les autres paramètres peuvent se calculer à partir des deux paramètres choisis par l'équation d'état. | L'état d'équilibre thermodynamique d'un gaz parfait est fixé ( n moles de molécules) par deux paramètres macroscopiques au choix. Les autres paramètres peuvent se calculer à partir des deux paramètres choisis par l'équation d'état. | ||
| - | L'équation la plus couramment utilisée est l'équation des gaz parfaits, une équation | + | L'équation la plus couramment utilisée est l'équation des gaz parfaits, une équation thermoélastique. |
[[Image:Gaz parfaits eq1.png]] | [[Image:Gaz parfaits eq1.png]] | ||
| Ligne 71 : | Ligne 71 : | ||
[[Image:Gaz parfaits froid.jpg]] | [[Image:Gaz parfaits froid.jpg]] | ||
| - | A l’inverse, si la température T augmente, le volume et la pression augmentent, | + | A l’inverse, si la température T augmente, le volume et la pression augmentent, le ballon se gonfle. |
[[Image:Gaz parfaits chaud.jpg]] | [[Image:Gaz parfaits chaud.jpg]] | ||
Version du 24 août 2008 à 12:51
Sommaire |
Matériel
-
 Un ballon de baudruche
Un ballon de baudruche
- Un saladier
- Fichier:Glaçon.jpg Des glaçons
-
 De l’eau froide
De l’eau froide
-
 De l’eau chaude
De l’eau chaude
-
 Du papier
Du papier
-
 Un crayon
Un crayon
L'expérience
En vidéo
La manipulation
- Gonfler un ballon un petit peu.
- Mettre le ballon dans un récipient rempli d’eau refroidie avec des glaçons.
- Observer la taille du ballon.
- Le mettre dans un récipient d’eau chaude.
- Observer de nouveau la taille du ballon.
Que voit-on ?
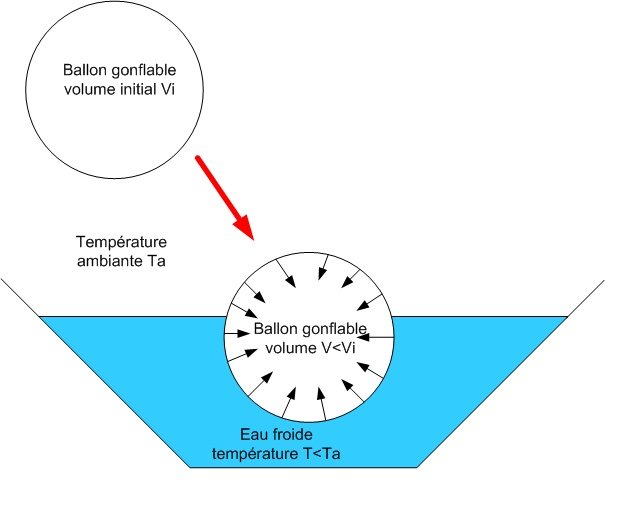
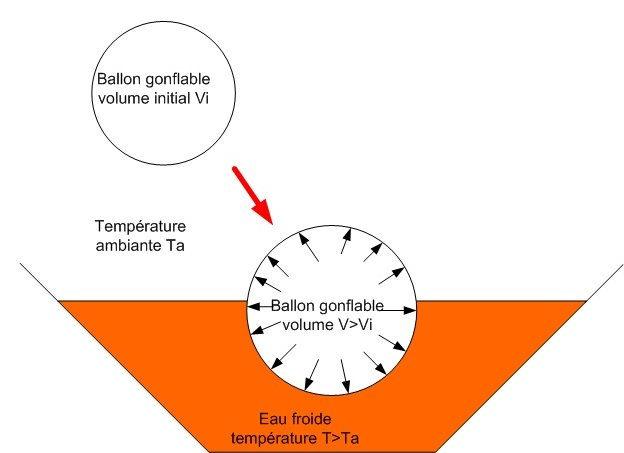
Lorsque le ballon est mis dans l’eau froide, il rétrécit, son volume diminue. Inversement, quand il est mis dans l’eau chaude, son volume augmente.
Explication
Lorsque le ballon est plongé dans de l’eau froide à une température inférieure à la température ambiante, son volume diminue. Au contraire, si le ballon est mis dans l’eau chaude, son volume augmente.
Ces phénomènes physiques sont dus à la loi des gaz parfaits qui indique que le volume et la pression d’un gaz varient en fonction de la température de celui-ci :
- Si la température augmente, le volume et/ou la pression des gaz augmentent.
- Si la température diminue, le volume et/ou la pression des gaz diminuent.
Concepts scientifiques associés
L'état d'équilibre thermodynamique d'un gaz parfait est fixé ( n moles de molécules) par deux paramètres macroscopiques au choix. Les autres paramètres peuvent se calculer à partir des deux paramètres choisis par l'équation d'état. L'équation la plus couramment utilisée est l'équation des gaz parfaits, une équation thermoélastique.
Celle-ci peut s’écrire sous deux formes :
- Une vision macroscopique (le volume de gaz intervient) :
- Une vision microscopique (le nombre de molécules contenues dans une unité de volume intervient) :
où :
- p est la pression (en pascal)
- V est le volume occupé par le gaz (en mètre cube)
- n est la quantité de matière, en mole
- N est le nombre de particules
- R est la constante des gaz parfaits
R = 8,314 472 J/(K.mol) on a en fait R = NA•kB où NA est le nombre d'Avogadro (6,022×1023 mol-1) et kB est la constante de Boltzmann (1,38×10-23 J/K) ;
- T est la température absolue (en kelvin).
Une fois le ballon gonflé et fermé, la quantité de matière à l’intérieur de celui-ci est constante :
Et donc
A partir de cette formule, on peut voir directement que le produit pression volume est proportionnel à la température. De fait, si la température T diminue, le volume et la pression diminuent, le ballon se dégonfle.
A l’inverse, si la température T augmente, le volume et la pression augmentent, le ballon se gonfle.
Liens avec d'autres expériences
Expériences sur le Wikidébrouillard
- La montgolfière... s'envoie en l'air
- Bougie dans le bocal
- Comment faire entrer un oeuf dans un bocal ?
Autres expériences
Liens internet.
Pourquoi ne pas créer la fiche expérience !
Applications : liens avec le quotidien
C'est de la culture, ça aide à comprendre le monde !!