Ramollir un oeuf !!
De Wikidebrouillard.
(→Résumons) |
|||
| Ligne 29 : | Ligne 29 : | ||
Le vinaigre va dissoudre la coquille d'oeuf pour former entre autre du dioxyde de carbone sous forme gazeuse. C'est la raison pour laquelle, on peut observer des bulles dans le verre. Le pigment qui donne sa couleur à l'oeuf ne se dissout pas et reste collé à la paroi de l'oeuf. En revanche, il n'est plus solidaire du carbonate de calcium qui formait la coquille de l'oeuf et un simple frottement permet de le retirer. | Le vinaigre va dissoudre la coquille d'oeuf pour former entre autre du dioxyde de carbone sous forme gazeuse. C'est la raison pour laquelle, on peut observer des bulles dans le verre. Le pigment qui donne sa couleur à l'oeuf ne se dissout pas et reste collé à la paroi de l'oeuf. En revanche, il n'est plus solidaire du carbonate de calcium qui formait la coquille de l'oeuf et un simple frottement permet de le retirer. | ||
| + | |||
| + | |||
| + | '''CORRECTION''' | ||
| + | L'eau dissous le sel car après évaporation (départ de l'eau), je retrouve le sel | ||
| + | MAIS | ||
| + | Le vinaigre ne dissous pas la coquille de l'oeuf car après évaporation (départ du vainaigre), il n'y a pas récupération de la coquille. | ||
| + | IL s'agit d'une réaction chimique et non d'une transformation physique. | ||
| + | (rx) | ||
===Poussons un peu plus loin...=== | ===Poussons un peu plus loin...=== | ||
Version du 15 décembre 2007 à 18:57
Sommaire |
Matériel
- un oeuf
- du vinaigre
- un verre, une assiette
L'expérience
- Met l'oeuf dans le verre
- Ajoute du vinaigre pour que la totalité de l'oeuf baigne dedans
- Attends quelques heures (une journée dans l'idéal)
- Vide le contenu du verre dans l'assiette
- Frotte le délicatement avec un couteau pour enlever la couleur rose
- Prend l'oeuf dans tes mains et observe sa texture
- Découpe l'oeuf dans l'assiette
Explication
Résumons
Le vinaigre va dissoudre la coquille d'oeuf pour former entre autre du dioxyde de carbone sous forme gazeuse. C'est la raison pour laquelle, on peut observer des bulles dans le verre. Le pigment qui donne sa couleur à l'oeuf ne se dissout pas et reste collé à la paroi de l'oeuf. En revanche, il n'est plus solidaire du carbonate de calcium qui formait la coquille de l'oeuf et un simple frottement permet de le retirer.
CORRECTION
L'eau dissous le sel car après évaporation (départ de l'eau), je retrouve le sel
MAIS
Le vinaigre ne dissous pas la coquille de l'oeuf car après évaporation (départ du vainaigre), il n'y a pas récupération de la coquille.
IL s'agit d'une réaction chimique et non d'une transformation physique.
(rx)
Poussons un peu plus loin...
- Lorsque l’on plonge un œuf dans du vinaigre, il se produit une réaction acido-basique. La base est le carbonate de calcium contenu dans la coquille. C’est le principal composé du calcaire. Il est insoluble dans l’eau et heureusement car sinon cuire un œuf ne serait pas de tout repos ! L’acide est l’acide acétique contenu dans le vinaigre (sa concentration est indiquée généralement sur la bouteille en %).
Lorsque que cette acide rencontre cette base, il se produit un dégagement gazeux (bulles) selon la réaction suivante :
Il y a donc également production d’eau et de bicarbonate de calcium. Ce dernier est soluble dans l’eau et donc ne se remarque pas à l’œil nu. Il est présent sous forme d’ions Ca(II) et d’ions bicarbonates.
- Lorsque la totalité du carbonate de calcium a été consommé, la réaction s’arrête. Il ne reste alors plus que la membrane de l’œuf pour contenir le jaune et le blanc. La couleur de la coquille n’a cependant pas disparu car les pigments n’ont pas été dissous au cours de la réaction. Ils se sont donc naturellement déposés sur cette membrane. Ils ne sont toutefois pas solidaires de cette dernière et le fait de simplement frotter le couteau dessus permet de les retirer.
On a alors l’impression d’avoir obtenu un œuf dur. Mais si l’on tient cet œuf entre les mains, on constate que celui-ci reste assez malléable et semble contenir un liquide.
Pour confirmer cette hypothèse, on déchire cette membrane. Le jaune et le blanc de l’œuf sont bien encore liquides. L’intérieur de l’oeuf est intact ? Pas si sûr…
- On pourrait conclure que la membrane de l’œuf est imperméable et n’a pas laissé passer le vinaigre à l’intérieur. Pourtant si on compare le pH du blanc de l’œuf de l’expérience avec celui d’un œuf intact, on constate qu’il est moins élevé dans le premier cas. Il semblerait donc que la membrane ne soit pas si imperméable et ait laissé passé un peu d’acide à l’intérieur. C’est ce qui permet d’ailleurs à l’œuf de respirer : il dégage du CO2 et se procure du dioxygène et l’humidité nécessaires à sa croissance.
En principe, on pourrait donc cuire un œuf juste avec du vinaigre. Pour s’en assurer il est possible de faire l’expérience suivante : verser le contenu d’un œuf dans un récipient et y ajouter du vinaigre. On observe alors la formation de filaments blancs. L’œuf coagule (comme lorsqu’on le cuit). Si on le laisse suffisamment longtemps (au moins 5 jours), la totalité de l’œuf aura coagulé.
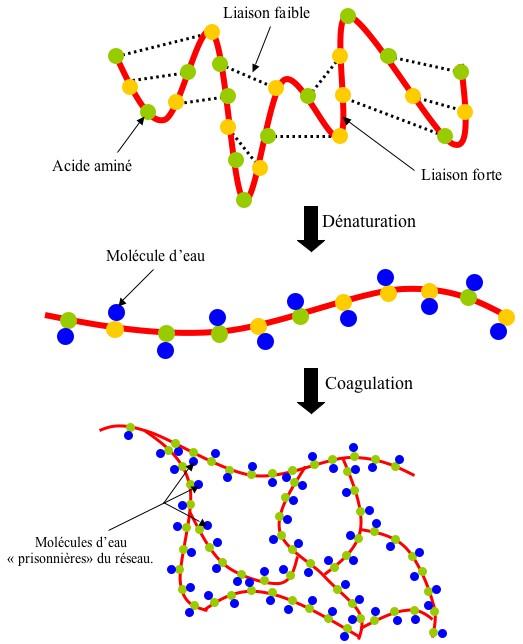
- Pas tant que ça quant on sait que l’œuf est principalement constitué de protéines comme l’ovalbumine. En effet, ces protéines sont constituées d’acides aminés attachés ensembles par des liaisons covalentes (fortes). Leur forme tridimensionnelle est assurée par des liaisons faibles de différentes natures. Or le fait d’abaisser le pH rompt un certain nombre de ces liaisons (dénaturation) et permet à cette chaîne prendre une forme linéaire. Cette nouvelle structure rend possibles certaines interactions avec d’autres molécules (elle a en quelque sorte « les bras libres »). Et notamment l’eau avec laquelle elle s’associe par l’intermédiaire de ponts disulfures (coagulation). L’interaction entre ces différentes chaînes construit un réseau qui emprisonne les molécules d’eau et rigidifie l’œuf.
- En revanche si vous faites cette expérience qui demande vraiment beaucoup de patience et de précautions, vous constaterez que l’œuf cuit de cette manière n’a pas vraiment un aspect très comestible. Pourtant il l’est…
- Pour voir des photos c’est par ici : [1]
Concepts scientifiques associés
Application : Lien avec le quotidien
On peut utiliser le vinaigre pour détartrer une cafetière.
Liens avec d'autres expériences
Comment l'animer ?
Liens avec des programmes d'animation
Comme par exemple "Debout les terriens", "foot'sciences", "6TdB", ...